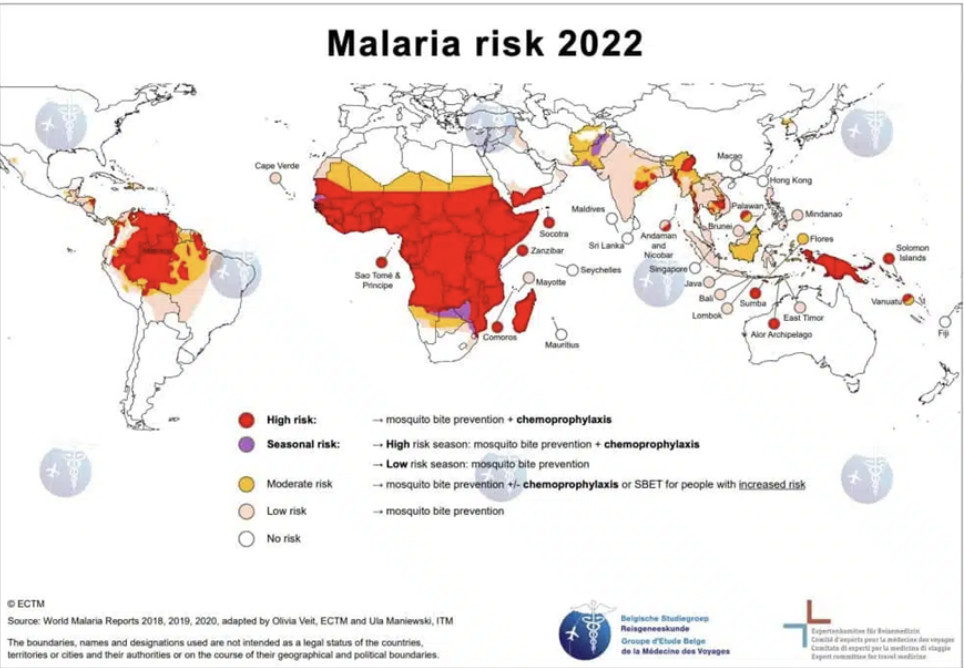
Le paludisme constitue un problème majeur de santé publique dans certaines régions du monde.
En 2021, 232 millions de cas de paludisme ont été enregistrés et 600 000 décès dont plus de 95% en Afrique subsaharienne, et près de 80 % d'entre eux touchent des enfants de moins de 5 ans chez lesquels le paludisme constitue la principale cause de mortalité.
Aussi tout moyen ayant fait ses preuves d'efficacité contre ce fléau est le bienvenu.
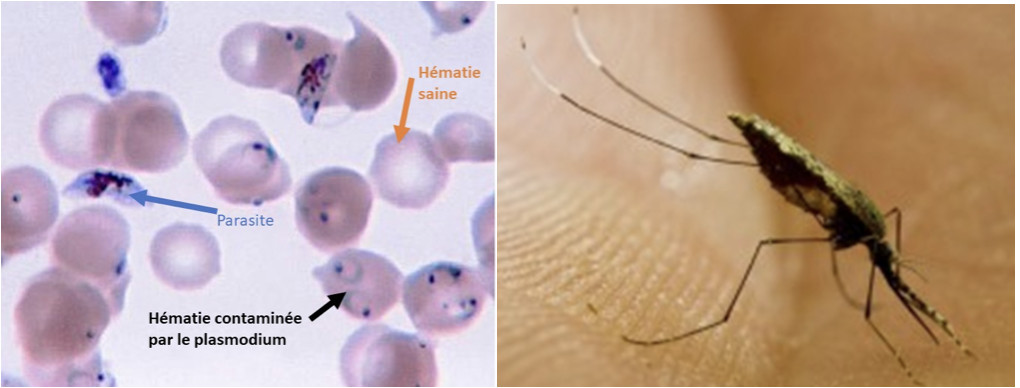
Le paludisme est une maladie parasitaire due à un Plasmodium observé en 1880 pour la première fois par Alphonse Laveran qui reçut pour ses travaux le premier prix Nobel de médecine français en 1907.
Il existe 5 espèces de plasmodies responsables du paludisme humain, dont deux sont particulièrement actifs : P. falciparum et P. vivax. Le premier est le plus répandu sur le continent africain et le responsable du plus grand nombre de de décès. P. vivax est l'espèce dominante dans la plupart des autres pays. Ils sont transmis à l'homme par la piqure d'un moustique anophèle femelle photographiée ici par l'institut Pasteur de Guyane.
Les premiers symptômes de la malaria semblables à de nombreuses maladies fébriles, sont parfois difficiles à reconnaître. En l'absence d'un traitement, le paludisme à P. falciparum peut évoluer vers une affection grave voire mortelle dans les 24 heures.
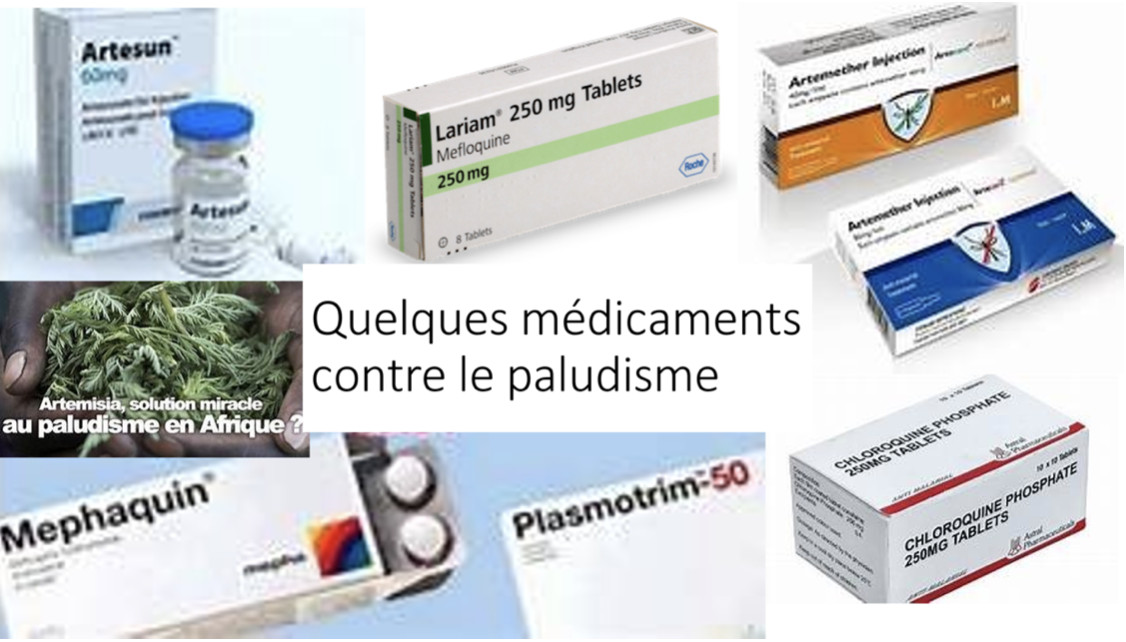
En complément de la suppression des eaux stagnantes et de la chasse aux moustiques, l'utilisation de moustiquaires imprégnées d'insecticide et de nombreux traitements à base de dérivés de quinine ou d'artémisinine ont prouvé leur efficacité.
L'espoir incertain des vaccins
Depuis plus d'un siècle la mise au point d'un vaccin contre le paludisme mobilise la recherche pharmaceutique mais sans grand succès jusqu'ici. Les vaccins antipaludiques parviennent rarement à atteindre une efficacité protectrice à la fois élevée et durable.
Le vaccin antipaludique Mosquirix™RTS,S/AS01 E est un vaccin protéique recombinant qui contient un composant de la protéine circumsporozoïte de Plasmodium falciparum fusionné à l'antigène de surface de l'hépatite B (AgHBs), co-exprimé dans la levure avec un AgHBs (S) libre pour former une particule semblable à un virus (RTS,S) administré avec l'adjuvant AS01a. En 2021 il a été approuvé par l'Organisation mondiale de la santé, qui recommande son intégration dans les programmes de vaccination de routine, en complément des mesures existantes de lutte contre le paludisme. Mais ce vaccin est peu efficace et potentiellement nocif chez les filles et chez les enfants vaccinés tardivement (5-7 ans).
Une efficacité insuffisante et trop courte.
Les vaccins très efficaces, comme le vaccin anti variolique ou celui contre la fièvre jaune, protègent les vaccinés totalement et à vie après seulement une injection. D'autres vaccins (vaccins contre la grippe ou contre le choléra), peu efficaces ne protègent qu'une fraction des vaccinés et durant une courte période. De nombreuses publications prouvent que Mosquirix fait malheureusement partie des vaccins peu efficaces.
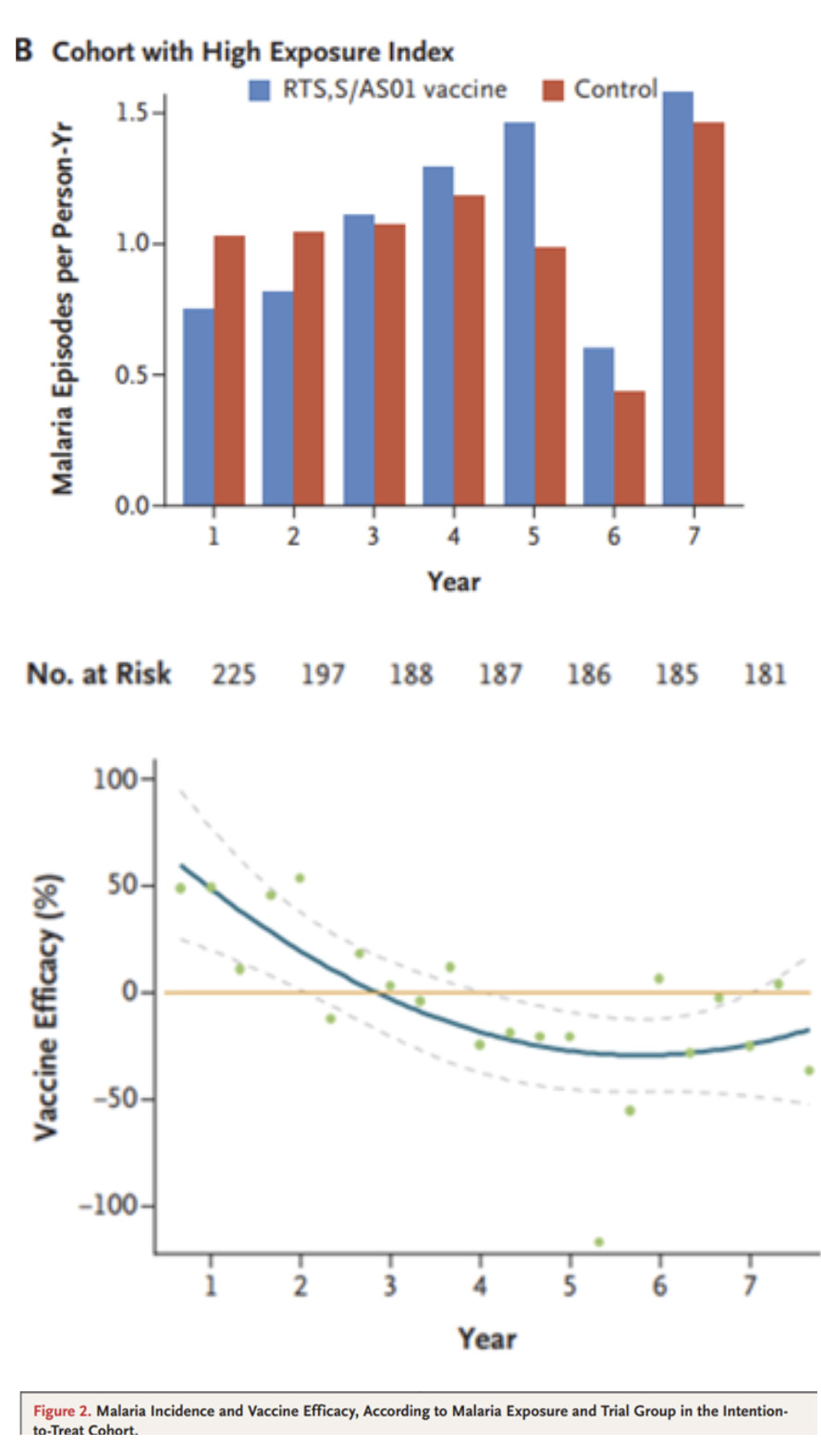
Une étude publiée en 2013 [1] conclue : "l'efficacité du vaccin RTS,S/AS01E sur la période de 4 ans est de 16,8 %". L'efficacité diminue avec le temps et avec l'augmentation de l'exposition au paludisme. aboutissant à une efficacité négative (le vaccin facilitant la maladie) au bout de 4 ans.
Trois ans plus tard la même équipe [2] a confirmé et détaillé ses premières constatations avec la chute rapide de la protection conférée parRTS,S/AS01 qui passe de 35.9% lors de la première année à seulement 4.4%, à 7 ans. En cas de forte exposition à la contagion au bout de 5 ans apparait même un effet de rebond, les vaccinés souffrant davantage du paludisme que les non vaccinés, comme le montrent les figures suivantes :
Une étude multicentrique [3]portant sur 11 sites différents en Afrique, et incluant 4 453 participants, réalisée par une autre équipe a confirmé la faible efficacité du vaccin contre la maladie clinique, sa plus rapide diminution en cas d'exposition à une contamination intense et sa durée trop limitée (indétectable 3 ans après la vaccination).
Un essai [4], destiné à évaluer le bénéfice de 3 ou de 4 doses de RTS,S/AS01 a constaté, une augmentation d'incidence de paludisme clinique chez les enfants vaccinés tardivement (entre 5 et 7 ans) par rapport au groupe de comparaison (non vacciné).
Surtout les résultats définitifs de l'essai de phase 3 [5], financé par le fabricant, constate que le vaccin ne réduit ni la mortalité globale, ni la mortalité due au paludisme, ni les infections secondaires, ni les pneumonies, alors que la disparition de la mortalité constitue le but de toute vaccination.
Les avocats chinois du vaccin RTS, S/AS01 reconnaissent d'ailleurs « qu'il souffre de faible efficacité protectrice (environ 30 %), qu'il nécessité de quatre doses et de courte durée d'immunité protectrice ».
D'autres partisans du RTS,S/AS01 précisent : « bien que les vaccins soient l'outil idéal pour contrôler, prévenir, éliminer et éradiquer de nombreuses maladies infectieuses, le développement de vaccins contre les parasites, comme celui contre le paludisme, est très complexe… Les résultats de cet essai de phase III suggèrent que ce vaccin candidat contre le paludisme est relativement peu efficace et qu'il ne parviendra apparemment pas à atteindre l'objectif d'éradication du paludisme à lui seul…des études plus approfondies sur l'utilisation d'autres cibles parasitaires et de stratégies de vaccination sont fortement recommandées. »
La diversité génétique des parasites constitue la principale raison de la résistance aux vaccins comme le montre une étude démontrant la résistance des variants possédant des séquences hétérologues par rapport au modèle du vaccin RTS, S.
L'efficacité insuffisante du vaccin [9, 10] a incité de nombreux auteurs à proposer des campagnes annuelles de vaccination ou à associer au vaccin une chimiothérapie saisonnière préventive constituée d'une association Sulfadoxine-Piryméthamine-Amodiaquine.
Un vaccin potentiellement dangereux
Les quelques essais randomisés destinés à préciser la toxicité n'ont pas comparé le vaccin à un placebo, mais à un adjuvant ou un autre vaccin (comme le vaccin antirabique [13]) et leur durée de suivi ne dépasse pas 2 mois ne permettant pas dévaluer les possibles effets secondaires. Si les investigateurs avaient voulu dissimuler la toxicité éventuelle, ils ne se seraient pas pris autrement..
Cependant un essai [14] a constaté que la vaccination RTS,S/AS01 était associée à un taux de létalité deux fois plus élevé chez les enfants atteints de paludisme grave.
Une autre étude prospective randomisée incluant 8 922 enfants et 6 537 nourissons constate [15] que la mortalité toutes causes confondues est plus élevée chez les filles vaccinées que chez les filles non vaccinées (2,4 % contre 1,3 %, tous âges confondus), une augmentation statistiquement significative des cas de méningite observée chez les enfants ayant reçu le vaccin à l'âge de 5 à 17 mois, et une augmentation possible de la proportion de cas graves de paludisme classés comme paludisme cérébral.
Les auteurs s'alarment : "les signaux de méningite observés sont considérés comme des "découvertes fortuites probables" qui, compte tenu de leur gravité, justifient une évaluation plus approfondie dans le cadre d'études de phase IV et de programmes pilotes de mise en œuvre dirigés par l'OMS pour établir le profil bénéfice-risque RTS,S/AS01 dans des contextes réels."
Cette mortalité plus élevée chez les filles après vaccination, statistiquement très significative a infiniment peu de chances d'être due au hasard (P=0,0006) [16]. Il existe malheureusement un précédent selon lequel les nourrissons filles ont souffert d'une mortalité accrue après vaccination [17, 18].
Ainsi dans les années 1980, lorsque le vaccin antirougeoleux à titre élevé (HTMV) a été introduit pour prévenir la rougeole chez les enfants de moins de 9 mois, la mortalité toutes causes confondues a doublé chez les filles, ce qui conduit au retrait du vaccin. Sera-ce le cas du vaccin RTS,S/AS01 ?
Les auteurs concluent : « ces chiffres suggèrent la nécessité d'être prudent et de mener des recherches supplémentaires. Avant d'introduire le RTS,S dans les programmes de vaccination de routine, nous devons déterminer si le RTS,S/AS01 augmente la mortalité chez les filles et en étudier les mécanismes possibles."
Mais l'OMS, comme pour les injections covid, saute toutes les étapes de sécurité pour faire vendre le plus rapidement possible le plus grand nombre de dose de vaccin Mosquirix™ pourtant si peu efficace et si peu longtemps, qu'elle précise "en complément des mesures existantes de lutte contre le paludisme", ce qui n'est jamais nécessaire pour un vaccin efficace.
Compte tenu de l'absence de diminution des transmissions après Mosquirix, ni de gain de survie, l'OMS prone un essai dangereux sur des populations entières, mal informées, des risques observés dans les essais précédents. Et certains états comme le Cameroun, se basant aveuglément sur cette recommandation OMS, veulent rendre ce vaccin obligatoire !
Il aurait été plus prudent d'exiger du fabricant des études approfondies sur les causes de l'augmentation de mortalité observée en cas de paludisme grave et chez les filles vaccinées avant toute recommandation.
L'OMS devrait aussi rappeler qu'on peut éradiquer le paludisme sans vaccin, comme viennent d'y parvenir récemment 12 pays certifiés exempts de paludisme parmi les 23 pays qui ont enregistré zéro cas paludisme indigène sur trois années consécutives grâce aux mesures d'hygiène et aux traitements par artemisine et aux associations médicamenteuses (ACTs) [19].
Citons l'exemple de l'Iran ou du Bangladesh qui ont fait pratiquement disparaître leurs cas autochtones grâce aux traitements saisonniers préventifs.
Mais pour les financeurs de l'OMS (bill Gates et big pharma) et leurs affidés, les dividendes des actionnaires des firmes de vaccin paraissent malheureusement prioritaires.
Dr Gérard Delépine
Notes :
1 Olotu A, Fegan G, Wambua J, Nyangweso G, Awuondo KO, Leach A, Lievens M, Leboulleux D, Njuguna P, Peshu N, Marsh K, Bejon P. Four-year efficacy of RTS,S/AS01E and its interaction with malaria exposure. N Engl J Med. 2013 Mar 21;368(12):1111-20. doi: 10.1056/NEJMoa1207564. PMID: 23514288; PMCID: PMC5156295.
2 Ally Olotu et al Seven-Year Efficacy of RTS,S/AS01 Malaria Vaccine among Young African Children The new england journal of medicine une 30, 2016 vol. 374 no. 26
3 Penny MA, Pemberton-Ross P, Smith TA. The time-course of protection of the RTS,S vaccine against malaria infections and clinical disease. Malar J. 2015 Nov 4;14:437. doi: 10.1186/s12936-015-0969-8. PMID: 26537608; PMCID: PMC4634589.
4 H Tinto et al Incidence à long terme du paludisme grave après la vaccination RTS,S/AS01 chez les enfants et les nourrissons en Afrique : une étude d'extension ouverte de 3 ans d'un essai contrôlé randomisé de phase 3
5 Enregistré sous ClinicalTrials.gov, numéro NCT00866619
6 RTS,S Clinical Trials Partnership. Efficacy and safety of RTS,S/AS01 malaria vaccine with or without a booster dose in infants and children in Africa: final results of a phase 3, individually randomised, controlled trial. Lancet. 2015 Jul 4;386(9988):31-45. doi: 10.1016/S0140-6736(15)60721-8. Epub 2015 Apr 23..
7 Zhang YL, Pan WQ. Le premier vaccin antipaludique au monde : espoir et défi [The world's first malaria vaccine: Hope and challenge]. Zhongguo Xue Xi Chong Bing Fang Zhi Za Zhi. 2022 Jan 10;33(6):560-562. Chinois
8 Neafsey DE, Juraska M., Bedford T., Benkeser D., Valim C., Griggs A., Lievens M., Abdulla S., Adjei S., Agbenyega T. et al. Diversité génétique et efficacité protectrice du vaccin antipaludique RTS, S/AS01. N. Engl. J.Méd. 2015 ; 373 : 2025-2037. est ce que je: 10.1056/NEJMoa1505819.
9 Greenwood B, Dicko A, Sagara I, Zongo I, Tinto H, Cairns M, Kuepfer I, Milligan P, Ouedraogo JB, Doumbo O, Chandramohan D. Seasonal vaccination against malaria: a potential use for an imperfect malaria vaccine. Malar J. 2017 May 2;16(1):182. doi: 10.1186/s12936-017-1841-9. PMID: 28464937; PMCID: PMC5414195.
10 Thompson HA, Hogan AB, Walker PGT, Winskill P, Zongo I, Sagara I, Tinto H, Ouedraogo JB, Dicko A, Chandramohan D, Greenwood B, Cairns M, Ghani AC. Seasonal use case for the RTS,S/AS01 malaria vaccine: a mathematical modelling study. Lancet Glob Health. 2022 Dec;10(12):e1782-e1792. doi: 10.1016/S2214-109X(22)00416-8. PMID: 36400084.
11 Chandramohan D et al Seasonal Malaria Vaccination with or without Seasonal Malaria Chemoprevention. N Engl J Med. 2021 Sep 9;385(11):1005-1017. doi: 10.1056/NEJMoa2026330. Epub 2021 Aug 25. PMID: 34432975.
12 Greenwood B, Cairns M, Chaponda M, Chico RM, Dicko A, Ouedraogo JB, Phiri KS, Ter Kuile FO, Chandramohan D. Combining malaria vaccination with chemoprevention: a promising new approach to malaria control. Malar J. 2021 Sep 6;20(1):361. doi: 10.1186/s12936-021-03888-8. PMID: 34488784; PMCID: PMC8419817.
13 Samuel AM, et al RTS,S study group. Efficacy of RTS,S/AS01E malaria vaccine administered according to different full, fractional, and delayed third or early fourth dose regimens in children aged 5-17 months in Ghana and Kenya: an open-label, phase 2b, randomised controlled trial. Lancet Infect Dis. 2022 Sep;22(9):1329-1342. doi: 10.1016/S1473-3099(22)00273-0. Epub 2022 Jun 23
14 Aaby P, Rodrigues A, Kofoed PE, Benn CS. RTS,S/AS01 malaria vaccine and child mortality. Lancet. 2015 Oct 31;386(10005):1735-6. doi: 10.1016/S0140-6736(15)00693-5. PMID: 26545433.
15 Guerra Mendoza Y, et al Safety profile of the RTS,S/AS01 malaria vaccine in infants and children: additional data from a phase III randomized controlled trial in sub-Saharan Africa. Hum Vaccin Immunother. 2019;15(10):2386-2398. doi: 10.1080/21645515.2019.1586040. Epub 2019 Apr 23..
16 Klein SL, Shann F, Moss WJ, Benn CS, Aaby P. RTS,S Malaria Vaccine and Increased Mortality in Girls. mBio. 2016 Apr 26;7(2):e00514-16. doi: 10.1128/mBio.00514-16. PMID: 27118593; PMCID: PMC4850267.
17 Aaby P, Knudsen K, Whittle H, Lisse IM, Thaarup J, Poulsen A, Sodemann M, Jakobsen M, Brink L, Gansted U, et al. Long-term survival after Edmonston-Zagreb measles vaccination in Guinea-Bissau: increased female mortality rate. J Pediatr. 1993 Jun;122(6):904-8. doi: 10.1016/s0022-3476(09)90015-4. PMID: 8501567.
18 Aaby P, Garly ML, Nielsen J, Ravn H, Martins C, Balé C, Rodrigues A, Benn CS, Lisse IM. 2007. Augmentation du taux de mortalité femmes-hommes associée aux vaccins inactivés contre la poliomyélite et la diphtérie-tétanos-coqueluche : observations issues d'essais de vaccination en Guinée-Bissau. Pediatr Infect Dis J 26 : 247-252.
19Is Bangladesh entering the Era of Malaria Elimination? speakingofmedicine.plos.org
La source originale de cet article est Mondialisation.ca
Copyright © Dr Gérard Delépine, Mondialisation.ca, 2023